Materi
5.5 Stoikiometri Gas
Jika reaktan dan/atau produk adalah gas, dapat juga digunakan hubungan antara jumlah zat (mol, n) dan volume (V). Contoh 5.11, 5.12, dan 5.13 menunjukkan bagaimana hukum gas digunakan dalam perhitungan ini.
Perhitungan stoikiometri yang melibatkan gas.
Contoh 5.11
Hitung volume O₂ (dalam liter) yang dibutuhkan untuk pembakaran total 7,64 L asetilena (C₂H₂) yang diukur pada suhu dan tekanan yang sama.
2C₂H₂(g) + 5O₂(g) → 4CO₂(g) + 2H₂O(l)
2 mol 5 mol
Jawaban :
Menurut hukum Avogadro, pada suhu dan tekanan yang sama, jumlah mol gas secara langsung berkaitan dengan volumenya. Dari persamaan, ada 5 mol O₂ ∞ 2 mol C₂H₂; oleh karena itu, dapat ditulis 5 L O₂ ∞ 2 L C₂H₂. Volume O₂ yang akan bereaksi dengan 7,64 L C₂H₂ diberikan oleh
Contoh 5.12
Natrium azida (NaN₃) digunakan dalam kantong udara (air bag) mobil. Dampak tabrakan memicu reaksi penguraian NaN₃ sebagai berikut:
2NaN₃(s) → 2Na(s) + 3N₂(g)
Gas nitrogen yang diproduksi dengan cepat meningkatkan volume kantong antara pengemudi dan kaca depan dan dashboard. Hitung volume N₂ yang dihasilkan pada 80°C dan 823 mmHg dari penguraian 60,0 g NaN₃.
Jawaban:
 |
Contoh 5.13
Larutan litium hidroksida dalam air digunakan untuk memurnikan udara dalam pesawat antariksa dan kapal selam karena larutan ini menyerap karbon dioksida, yang merupakan produk akhir dari metabolisme, menurut persamaan
2LiOH(aq) + CO₂(g) → Li₂CO₃(aq) + H₂O(l)
Tekanan karbon dioksida di dalam kabin kapal selam yang memiliki volume 2,4 x 10⁵ L adalah 7,9 x 10⁻³ atm pada 312 K. Larutan litium hidroksida (LiOH) dengan volume yang dapat diabaikan dimasukkan ke dalam kabin. Akhirnya tekanan CO₂ turun menjadi 1,2 x 10⁻⁴ atm. Berapa gram litium karbonat yang terbentuk oleh proses ini?
Jawaban:
Hitung jumlah mol CO₂ yang bereaksi dari penurunan tekanan CO₂
Penurunan tekanan CO₂ adalah (7,9 x 10⁻³ atm) - (1,2 x 10⁻⁴ atm) atau 7,8 x 10⁻³ atm. Oleh karena itu, jumlah mol CO₂ yang bereaksi diberikan oleh :
bahwa 1 mol CO₂ ∞ 1 mol Li₂CO₃, sehingga jumlah Li₂CO₃ yang terbentuk juga 73 mol. Kemudian, dengan massa molar Li₂CO₃ (73,89 g), dapat dihitung massanya:
5.6 Hukum Dalton : Tekanan Parsial
Hukum Dalton berhubungan dengan campuran gas, yang di dalam sebuah campuran terdapat dua atau tiga unsur gas bahkan lebih, maka hukum Dalton inilah yang akan mengitung tekanan gas masing-masing unsur pembentuk campuran tersebut. Dalton mengatakan tekanan total dari campuran gas merupakan jumlah dari tekanan yang diberikan oleh masing-masing gas yang ada dalam campuran,pernyataan inilah yang di sebut hokum tekanan parsial.
Menurut persamaan gas ideal tekanan gas :
Kemudian untuk mrngetahui bagaimana setiap tekanan parsial terkait dengan tekanan total, kita bisa menguji dengan membagi tekanan gas A dengan tekanan total:
Dimana XA sebagai fraksi mol A .Jadi dapat di buat persamaan baru keterkaitan tekanan gas A dang Tekanan total, begitu juga dengan gas yang lainnya.
PA = XAPT
Contoh soal:
Campuran gas yang mengandung 4,46 mol neon(Ne), 0,74 mol argon(Ar), dan 2,15 mol xenon(Xe). Hitunglah tekanan parsial pada gas neo(Ne) jika tekanan totalnya sebesar 2,00 atm pada suhu tertentu.
Pembahsan:
Diket : PT = 2,00 atm
Mol neon = 4,46 mol
mol argon = 0,74 mol
mol xenon = 2,15 mol
PNe = XNe . Pt
XNe = mol Ne / mol Ne + mol Ar + mol Xe
= 4,46 / 4,46 + 0.74 + 2,15
= 0,67
PNe = 0.67 . 2.00
= 1,21 atm
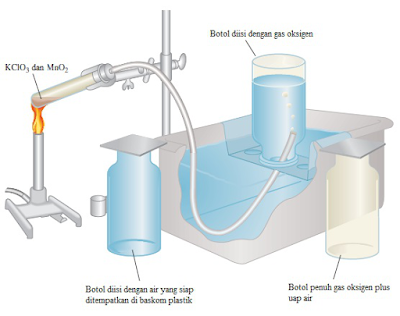
Hukum Dalton juga berguna untuk menghitung volume gas di atas permukaan air. Gas oksigen dapat di kumpulkan di atas permukaan air seperti gambar di bawah. Awalnya botol diisi penuh dengan air, kemudian kedalam botol ditambahkan oksigen .Gelembung gas naik ke atas dang menekan air keluar dari botol.Persamaan nya dapat ditulis:
5.7 Teori Kinetika Molekul Gas
Pada abad kesembilan belas, beberapa orang fisikawan, terutama Ludwig Boltzmann dan James Clerk Maxwell, menemukan bahwa sifat fisik gas dapat dijelaskan dalam hal pergerakan masing-masing molekul. Gerakan molekul ini adalah bentuk energi, yang didefinisikan sebagai kapasitas untuk melakukan kerja atau untuk menghasilkan perpindahan. Energi dapat diukur sebagai kerja, dapat dituliskan :
Energi (joule) = gaya x perpindahan
Energi kinetik (KE) adalah jenis energi yang dikeluarkan oleh objek atau benda bergerak, atau energi gerak. Inti dari teori kinetika gas :
1. Gas terdiri dari molekul-molekul yang terpisah antara satu sama lain dengan jarak yang jauh lebih besar daripada dimensi molekul-molekul itu sendiri.
2. Molekul-molekul gas senantiasa bergerak secara tetap dengan arah yang acak, dan molekul-molekul gas sering bertabrakan antara satu sama lain. Tabrakan antar molekul bersifat elastis sempurna. Dengan kata lain, energi dapat ditransfer dari satu molekul ke molekul yang lain sebagai akibat dari tabrakan.
3. Molekul-molekul gas tidak memberikan gaya tarik maupun gaya tolak antara satu sama lain.
4. Energi kainetik rata-rata molekul sebanding dengan suhu gas dalam Kelvin. Energi kinetik rata-rata dari suatu molekul diberikan oleh
Aplikasi Hukum Gas
1. Kompresibilitas Gas. Karena molekul dalam fasa gas dipisahkan oleh jarak yang besar (asumsi 1), gas dapat dikompresi dengan mudah untuk menempati volume yang lebih kecil.
2. Hukum Boyle. Tekanan yang diberikan oleh gas dihasilkan sebagai akibat tumbukan molekul-molekulnya pada dinding wadah. Laju tumbukan, atau jumlah tumbukan molekul dengan dinding per detik, sebanding dengan kerapatan jumlah gas. Karena alasan ini, tekanan gas berbanding terbalik dengan volume yang ditempatinya; saat volume menurun, tekanan meningkat dan sebaliknya.
3. Hukum Charles. Karena rata-rata energi kinetik molekul gas sebanding dengan suhu mutlak sampel, menaikkan suhu akan meningkatkan energi kinetik rata-rata. Akibatnya, molekul akan bertabrakan dengan dinding wadah lebih sering dan dengan pengaruh yang lebih besar jika gas dipanaskan, dan dengan demikian tekanan meningkat.
4. Hukum Avogadro, bahwa tekanan gas berbanding lurus dengan kerapatan dan suhu gas. Karena massa gas berbanding lurus dengan jumlah mol (n) gas
5. Hukum Tekanan Parsial Dalton. Jika molekul-molekul tidak saling tarik-menarik atau saling tolak-menolak satu sama lain. Akibatnya, tekanan total diberikan oleh jumlah tekanan masing-masing gas.
Teori kinetika gas memungkinkan untuk menyelidiki gerakan molekul secara lebih rinci. Maxwell menganalisis perilaku molekul gas pada temperatur yang berbeda.
 |
Gambar 5.17 (a) Distribusi kecepatan untuk gas nitrogen pada tiga suhu berbeda. Pada suhu yang lebih tinggi, lebih banyak molekul bergerak dengan kecepatan lebih cepat. (b) Distribusi kecepatan untuk tiga gas pada 300 K. Pada suhu tertentu, molekul yang lebih ringan rata-rata bergerak lebih cepat.
Akar-Rata-rata-Kuadrat Kecepatan
Salah satu cara untuk memperkirakan kecepatan molekul adalah dengan menghitung akar-rata-rata-kuadrat (rms) kecepatan (rms), yang merupakan kecepatan molekul rata-rata. Salah satu hasil dari teori kinetik gas adalah bahwa total energi kinetik satu mol gas sama dengan ³/₂RT, dirumuskan :
Difusi dan Efusi Gas
1. Difusi Gas
Demonstrasi langsung dari gerak acak gas disediakan oleh difusi, proses difusi membutuhkan waktu yang relatif lama untuk diselesaikan. Misalnya, ketika sebotol larutan amonia pekat dibuka di salah satu ujung bangku laboratorium, diperlukan beberapa saat sebelum seseorang di ujung bangku yang lain dapat mencium baunya. Alasannya adalah bahwa molekul mengalami banyak tabrakan saat bergerak dari satu ujung bangku ke ujung bangku yang lain. Jadi, difusi gas selalu terjadi secara bertahap, dan tidak secara instan sesuai dengan kecepatan molekul yang tampak.
Pada tahun 1832 ahli kimia Skotlandia Thomas Graham menemukan bahwa laju difusi untuk gas berbanding terbalik dengan akar kuadrat dari massa molarnya. Pernyataan ini, sekarang dikenal sebagai hukum difusi Graham, dinyatakan secara matematis sebagai
Dari massa molar Br₂, dapat dituliskan
2. Efusi Gas
Difusi adalah proses di mana satu gas secara bertahap bercampur dengan yang lain, sedangkan efusi adalah proses di mana gas di bawah tekanan luar dari satu kompartemen wadah ke wadah lain dengan melewati lubang kecil.
Gambar 5.21 Efusi gas. Molekul gas bergerak dari daerah bertekanan tinggi (kiri) ke daerah bertekanan rendah melalui lubang jarum.
5.8 Penyimpangan perilaku gas ideal
Hukum gas dan teori kinetika gas menyebutkan,pada umumnya mulekul-mulekul gas menunjukkan bahwa gas tersebut tidak dapat melakukan gaya apapun, termasuk gaya untuk tarik-menarik,kemudian mulekul dalam bentuk gas tersebut umumnya volume mulekulnya lebih kecil dari pada ruang yang ditempatinya.Kedua sifat tersebut cukup membuktikan bahwa mulekul gas tersebut adalah gas ideal.
Meskipun gas nyata tersebut adalah ga ideal, tetapi ada beberapa kondisi yang menyebabkan gas tersebut melakukan penyimpangan dari sifat gas ideal.Dan dalam kondisi bagaimana gas tersebut menunjukkan penyimpangan tersebut.
Dari yang paling sedehana bisa kita lihat saat gas tersebut didinginkan. Dengan mendinginkan suhu gas, gaya energy kinetik dari gas akan berkurang sehingga gas akan membentuk energy baru yang menyebabkan gaya tarik menarik antarmulekul,dan hal ini juga terjadi pada saat pengembunan.
Kita perlu melakukan modifikasi terhadap persamaan gas ideal agar kita dapat mempelajari gas nyata tersebut dengan akurat. Adalah J.D. van derr Waals seorang fisikawan Belanda yang melakukan modifikasi persamaan gas idela dengan pendekatan terhadap volume dang gaya antarmulekul. Pendekatan dimulai dari pengandaian terhadap pergerakan mulekul, di dapatkan persamaan:
Dimana a adalah konstanta dan n dan V masing masing adalah mol dang volume wadah. Inetraksi antar mulekul menimbulkan perilakiu gas nonideal tergantung seberapa besar mulekul tersebut mengalami pertemuan.Frekkunsi pertemuan tersebut vterung meningkat secara kuadrat dari jumlah kadrat persatuan volume yang dinamakan dengan faktor koreksi.
Pendekatan yang sama dilakukan kepada volume yang ditemoati mulekul gas.Setiap mjulekul menenpati volume wadah secara terbatas dan sangat kecil,sehingga di dapatkan persamaan baru (V-nb),dimana V adalah volume wadah dan b adalah konstanta. Setelah memperhitungkan koreksi terhadap volume dan tekanan maka di dapatlan persamaan baru:
Nilai a menunjukkan seberapa kuat mulekul melakukan gaya Tarik menarik dengan mulekul lain,kemudian untuk nilai b, semakin besar mulekul atau atom semakin besar juga nilai b dari mulekul atau atom tersebut.Berikut adalah konstantata van derr Waals dari beberapa gas
Contoh soal:
Diketahui 3,50 mol NH3 menempati 5,20 L pada suhu 47o C . Hitunglah tekanan gas menggunakan persamaan gas ideal dan persamaan van derr Waals nya.
Pembahasan:
Diket: V = 5,20 L
T = ( 47 + 273 )K = 320K
n = 3,50 mol
R = 0,0821 atm/K.mol
a = 4,17 atm.L2/mol2
b = 0,0371nl/mol
Jawaban :
a. P = nRT/V = 3,50 . 0,0821 . 320 / 5,20
= 17,7 atm
b. an2/V2 = 4,17 . (3,50)2
=1,89 atm
nb = 3,50 . 0,0371
= 0,130
Jadi persamaan van derr Wals nya
(P + an2/V2) . ( V – nb) = nRT
= (P + 1,89) . ( 5,20 – 0,130 ) = 3,50 . 0,0821 . 320
P = 16,2 atm
Download
Materi kimia : Link


























Komentar
Posting Komentar